Ventajas de los productos bajos en endotoxinas
por Kathy Miscioscio
¿Qué son las endotoxinas y por qué son importantes?
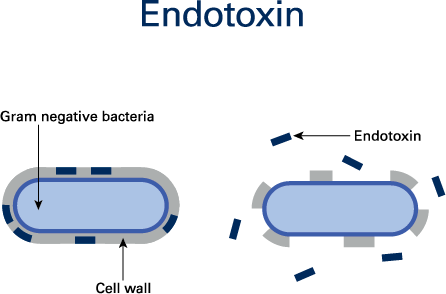
Las endotoxinas bacterianas se liberan de las membranas externas de las bacterias Gram negativas en descomposición. Al ser un tipo de pirógeno, las endotoxinas bacterianas producen fiebre en humanos y animales y pueden suponer un riesgo grave para los pacientes.
a los pacientes (Figura 1).
El término "pirógeno microbiano", en contraposición a "endotoxina bacteriana gramnegativa", se ha convertido en un término descriptivo general para muchas sustancias diferentes. Sin embargo, las sustancias pirógenas pueden ser producidas por algunas bacterias Gram-positivas, micobacterias, hongos y también virus, pero los pirógenos producidos por bacterias Gram-negativas son de importancia para la industria farmacéutica.
Las endotoxinas bacterianas pertenecen a una clase de fosfolípidos denominados lipopolisacáridos (LPS). La liberación de LPS de las bacterias tiene lugar tras la muerte y el estallido de la pared celular. Ejemplos de bacterias Gram negativas que liberan endotoxinas son Escherichia coli, Proteus, Pseudomonas, Enterobacter y Klebsiella.1
Los fabricantes de productos farmacéuticos y dispositivos médicos están obligados a comprobar los niveles de endotoxinas de sus productos. La presencia de pirógenos es un problema de seguridad crítico, ya que estas sustancias no pueden eliminarse fácilmente. A diferencia de los contaminantes microbianos viables, que pueden destruirse mediante diversas técnicas de esterilización, los pirógenos son difíciles de eliminar y desactivar.
La importancia de los productos consumibles bajos en endotoxinas
La FDA establece los límites de endotoxinas para los productos farmacéuticos producidos en EE.UU. o importados a este país. Los límites de endotoxinas se establecen en el capítulo <161> de la USP, Conjuntos de transfusión e infusión y productos sanitarios similares. El requisito de la USP para productos sanitarios especifica un límite de 0,5 EU/mL
(unidad de endotoxina/mL) o 20 EU/dispositivo para los productos que entran en contacto directo o indirecto con los sistemas cardiovascular y linfático. El límite para los productos en contacto con el líquido cefalorraquídeo es de 0,06 EU/ mL o 2,15 EU/dispositivo.2
La FDA estadounidense afirma que "es difícil eliminar las endotoxinas de los productos una vez presentes. Es mucho mejor mantener los productos acabados y los componentes relativamente libres de endotoxinas que tener que eliminarlas una vez presentes".1 Por lo tanto, es importante controlar el nivel de unidades de endotoxinas en los materiales utilizados en la producción de medicamentos y productos sanitarios.
Las endotoxinas pueden ser introducidas en un producto o proceso por los operarios, las materias primas, los materiales secundarios y los disolventes, como los productos de limpieza, que se utilizan en la formulación o fabricación de productos farmacéuticos. El agua es una fuente de endotoxinas especialmente preocupante. Agua para inyectables (WFI) El agua para inyectables (WFI) se utiliza en la producción de medicamentos parenterales y otros productos críticos cuando los niveles de endotoxinas deben ser controlados. Los límites de endotoxinas en WFI se establecen en la monografía de la USP sobre agua para inyectables3 y en la monografía de la Farmacopea Europea (Ph. Europe) sobre agua para inyectables4.
El agua purificada puede utilizarse en la producción de preparados no parenterales y en otras actividades como la limpieza de equipos. El agua de origen puede purificarse por varios medios, como la desionización (DI) y la ósmosis inversa (RO). El gráfico (Figura 2) compara la especificación del agua purificada con las especificaciones WFI estadounidenses y europeas.
¿WFI o certificado de baja endotoxina?
No existen normativas sobre los niveles de endotoxinas en las toallitas para salas blancas y los productos con alcohol. Sin embargo, la convención es que los productos bajos en endotoxinas cumplan el requisito USP de <0,5 EU/ml o <20 EU/dispositivo. Los productos certificados como de baja endotoxina no están obligados a utilizar ingredientes de baja endotoxina, como el WFI, pero el producto final debe someterse a pruebas de conformidad con los requisitos de la USP para los niveles de endotoxina. Los productos acabados que contienen WFI tienen un componente (agua) que es
baja endotoxina, pero para que el producto final se clasifique como de baja endotoxina, debe someterse a pruebas para cumplir los límites establecidos y garantizar que todos los componentes del producto, el envasado y los ciclos de fabricación se han controlado para producir un resultado de baja endotoxina.
Resumen
Como ya se ha dicho, es mucho más eficaz prevenir la introducción de endotoxinas en los procesos y productos que eliminarlas posteriormente. El uso de productos bajos en endotoxinas puede minimizar el riesgo de contaminación por endotoxinas de un producto farmacéutico, minimizando así el riesgo de reacciones adversas de los pacientes a los medicamentos intravenosos (inyectados). Para ayudar a conseguir ese objetivo, Contec fabrica una línea completa de productos certificados de baja endotoxina, que incluye toallitas presaturadas, toallitas secas de punto y no tejidas, peróxido de hidrógeno y alcohol isopropílico estéril al 70%, para las aplicaciones más críticas. Cada lote se somete a pruebas antes de su comercialización para garantizar un bajo nivel de endotoxinas.
Referencias
1 Guías técnicas de inspección de la FDA > Endotoxinas bacterianas/pirógenos, Fecha: 3/20/85 Número: 40
2 USP capítulo <161>, Conjuntos de transfusión e infusión y productos sanitarios similares
3 Monografía USP, Agua para inyección
4 Farmacopea Europea, Monografía sobre agua para inyección (0169)
